Die Leber ist jenes Organ, das am häufigsten von Metastasen des Darmkarzinoms - der zweithäufigsten krebsbedingten Todesursache weltweit - besiedelt wird. Die genauen Entstehungsmechanismen dieser mit einer schlechten Prognose verbundenen Ableger des Primärtumors sind bisher nicht ausreichend erforscht. Noch fehlen Krebsmodelle, an denen kolorektale Lebermetastasen und damit die Tumorbiologie unter möglichst realen Bedingungen in menschlichen Organen untersucht werden können.
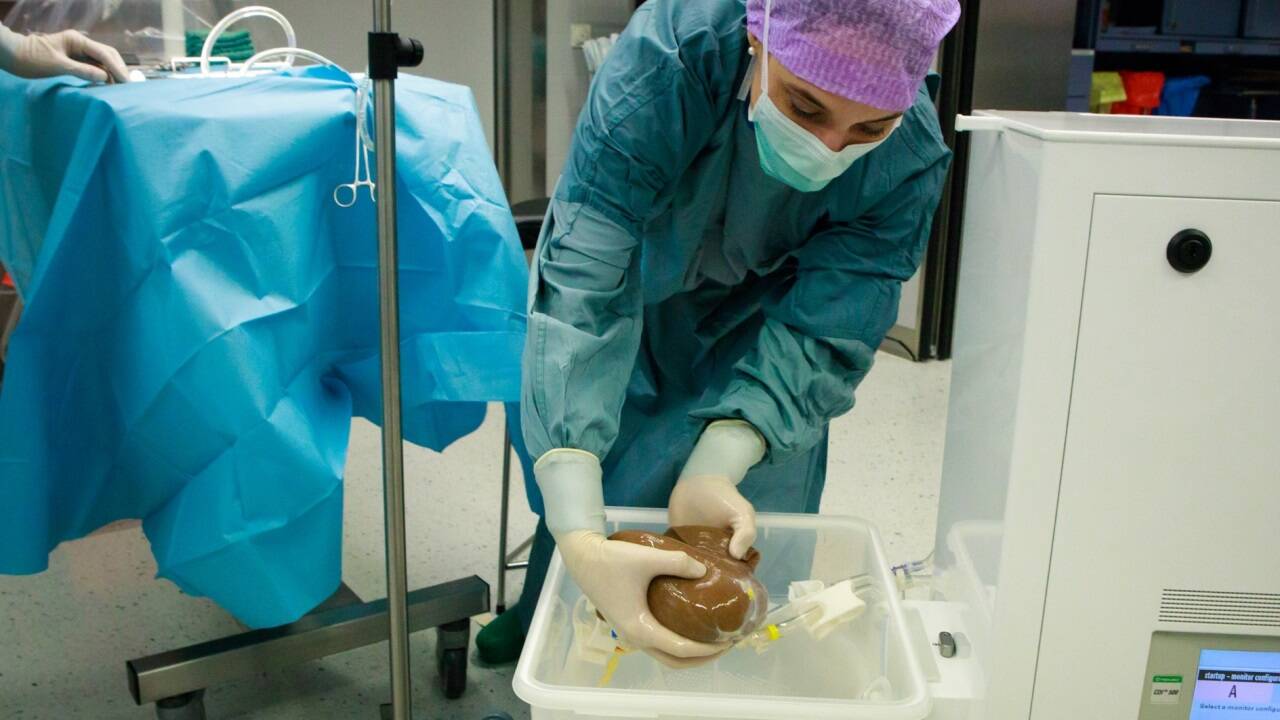
Wie die Medizinische Universität Innsbruck am Mittwoch mitteilte, könnte sich das dank der Forschungsergebnisse eines interdisziplinären Teams um den Hämato-Onkologen Andreas Pircher und den Transplantationschirurgen Rupert Oberhuber bald ändern. Die Erkenntnisse wurden in der im hochrangigen Journal "Molecular Cancer" veröffentlichten Forschungsarbeit präsentiert. Die erfolgreiche und bereits mehrfach bewährte Zusammenarbeit der Forschenden von der Univ.-Klinik für Hämatologie und Onkologie sowie der Univ.-Klinik für Viszeral-, Thorax- und Transplantationschirurgie soll den Weg zu einem zukunftsweisenden Krebsmodell ebnen, mit dem Tumorzellen sehr nah am Menschen analysiert, neue Therapieansätze entwickelt und spezifische Behandlungen getestet werden könnten. Die normotherme Maschinenperfusion (NMP) bietet die Möglichkeit, ein Organ wie die Leber außerhalb des Körpers am Leben zu erhalten - ideale Voraussetzungen, um das Verhalten und die Dynamik von Zellpopulationen zu studieren und unser Verständnis über die Umgebungsbedingungen eines Tumors und die Mechanismen der Metastasierung zu erweitern. Das haben wir uns zunutze gemacht", beschreibt Andreas Pircher die vorteilhaften Rahmenbedingungen am Standort.
Organe entnommen und untersucht
Für die Innsbrucker Forschungsarbeit wurden im Zeitraum von fünf Jahren sechs Lebern bzw. Leberteile, die bei Tumoroperationen oder einer Lebertransplantation entnommen worden waren, mittels normothermer Maschinenperfusion über Tage konserviert und untersucht. "Mit der normothermen Maschinenperfusion ist es heute in der Transplantationsmedizin standardmäßig möglich, eine Leber bis zu 48 Stunden zu durchbluten und für die Implantation vorzubereiten. Für unsere Forschungszwecke gelang es, die Konservierung metastasierter Lebern auf bis zu sieben Tage auszudehnen", berichtet Transplantationschirurg Rupert Oberhuber. Somit konnten die Innsbrucker Forschenden das Verhalten der Krebszellen und deren Umgebung außerhalb des Körpers unter lebensnahen Bedingungen analysieren und neue Einblicke in eine hochkomplexe Dynamik gewinnen.
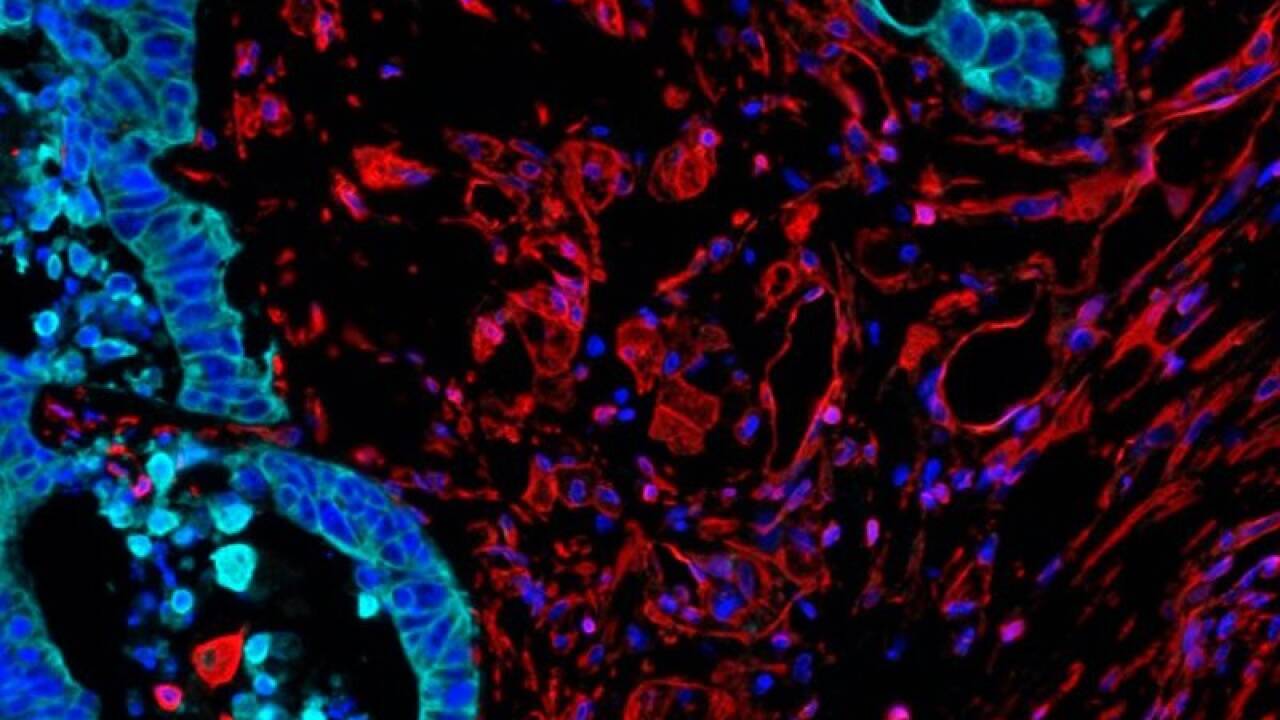
Alle Zellen lassen sich abbilden und erforschen
Der Mehrwert dieses Modells liegt vor allem darin, dass sich in der durchbluteten Leber die Gesamtheit aller dort vorkommenden Zellen abbilden und erforschen lässt. So konnten die Forschenden nachweisen, "dass bestimmte Immunzellen - sogenannte myeloide Zellen - durch lokale Faktoren im Tumorgewebe zurückgehalten werden", sagte Erstautor Manuel Trebo. Gemeint seien vor allem SPP1-positive myeloische Zellen, die in fibrotischen, sauerstoffarmen Nischen verweilen und andere Immunzellen fernhielten. Diese langlebigen Zelltypen dürften Trebo zufolge das Tumorwachstum fördern und mit einer schlechteren Prognose bei Darmkrebs verbunden sein. Um die zelluläre Zusammensetzung des Tumors im durchbluteten Organ über die Zeit charakterisieren zu können, nutzten die Forschenden modernste Technologien und konnten verschiedene Zelltypen im Tumorgewebe nicht nur identifizieren, sondern auch lokalisieren - wichtige Hinweise, um die komplexe Tumorbiologie darstellen und für zukünftige Therapieforschung einsetzen zu können. Mit der Verknüpfung der angewandten Technologien lieferten die Forschenden erstmals eine Basis für die Funktionstätigkeit und Tauglichkeit der normothermen Maschinenperfusion als innovatives ex vivo-Tumormodell, teilte die Medizinische Universität Innsbruck mit. Es sind noch weitere Studien notwendig.